1、引言
3D打印又称增材制造(Additive Manufacturing, AM),其思想在19 世纪首次被提出,但真正有一个质的飞越是在20 世纪80 年代。2010 年,报道称美国公司的3D生物打印机,已经能实现20μm的打印精度,能够打印出多种人体组织和器官[1]。发展至今,3D打印已经能制造一定精度的产品,并逐渐被广泛使用[2]。由于其强大和高效的工业制造能力,3D打印成为了最具前途和革命性的技术之一[3]。金属3D打印出现,解决了很多医用领域的难题,备受追捧[4]。在医疗领域,该技术在人工骨的制备上也发挥了极大的价值。人工骨材料被植入人体,用于修复骨缺损,直接与人体组织直接接触,替代缺损骨骼实现正常骨骼的功能,所以其必须符合医用材料的使用要求[5]。TC4钛合金,也称5级钛(Ti-6Al-4V),是钛合金的一种,它因具有优秀的力学强度、耐腐蚀性能、生物相容性等,被广泛应用于医疗领域,常被作为人工骨材料,植入人体治疗骨缺损[6] [7]。遗憾的是,致密的TC4钛合金弹性模量仍然过高,作为骨科植入物时,高于人骨的弹性模量会带来“应力屏蔽”效应,造成植入物周围骨组织流失,最终导致植入物失效[8] [9]。TC4钛合金的另一个关键的缺点是表面缺乏生物活性,作为人工骨植入骨组织,与自然骨的骨结合不够稳固,容易在承受载荷的时候造成松动[10]。松动对人工骨来说是严重的,它会导致种植体的失败。致密钛合金的缺点导致这种优良的金属材料被限制使用。然而目前没有发现更完美的替代材料,于是研究人员们一直在致力于更正TC4钛合金的缺点,并继续使用它。为了降低钛合金产品的弹性模量,并一定程度上改善其生物活性,人们提出了多孔结构的钛合金材料,该方法被很多学者证实确实行之有效[11] [12]。多孔结构的设计补偿了TC4钛合金一部分缺点。传统的制造工艺,制造孔隙率可控的多孔结构仍然困难,3D打印的出现使人们看到新的希望,但目前该技术仍面临着产品质量不够理想、产品性能令人担忧等有待解决的问题和挑战。本文主要从3D打印的TC4钛合金的优势、产品质量、机械性能、生物相容性、生物安全性、耐腐蚀性能和表面改性进行综述,并引用多例临床使用的3D打印制造的TC4钛合金人工骨的治疗效果进行举证,以说明3D打印TC4钛合金人工骨的可行性。
2、3D打印医用钛合金的优势
在 3D打印技术出现以前,传统的医用领域的TC4钛合金产品的制造方式大多是通过减材制造的方式生产。对于批量生产的TC4钛合金件,减材制造更加快速,且成本低。但是对于人工骨,不需要批量制造,因为它的需要往往是个性定制。对于制造复杂、不规则的结构,传统的加工方式受到很大的限制,而且对非标、非批量需求的产品,传统的制造技术制造的成本高。在医用领域,制造人工骨结构,减材制造的方式不具备成本优势,3D打印技术则可在较大程度上解决相关问题。将钛合金种植体制造成多孔结构能降低种植体的弹性模量,进而降低由于弹性模量不匹配而引起的“应力屏蔽”效应[13] [14]。“应力屏蔽”效应是一种缺点,会促进的植入物周围的骨流失,骨流失会导致种植体的失败[15] [16] [17] [18]。李、郑、孙等学者[19] [20] [21]认为,表面具有多孔结构的TC4钛合金,还能一定程度上改善表面的生物活性,更适合成骨细胞的增殖分化,骨整合能力更佳。而比起减材制造,增材制造制备孔隙可控的多孔钛合金件更加简便[22],简便的工序必将带来成本优势。
3、3D打印医用钛合金人工骨的性能
3.1. 产品质量
先进的加工工艺,首先需要解决的是产品的质量问题。在医用领域,3D打印的TC4钛合金人工骨,根据设计的模型进行制造,产品的各个尺寸的误差必须在可接受的范围内。在以往的研究中[23],有的学者尝试利用选择性激光熔融技术(Selective Laser Melting, SLM)制备具有多孔网状结构的TC4钛合金下颌骨,产品的孔互联良好,结构无断裂裂纹缺陷,孔隙率可控,产品质量良好;当将打印模型设计成钻石分子的结构,小孔结构0.2 mm,产品的结构虽然存在一定的制造误差,轮廓依然清晰;成品表面由于覆盖球状半熔融金属颗粒,表面形貌凹凸不平。这些表面问题对3D打印技术来说似乎是难以避免,粗糙的表面造成了产品误差。3D打印的TC4钛合金产品,如果不经过任何处理,直接用于部件之间的装配,可能由于几何尺寸和表面光洁度偏差大,造成装配效果糟糕。解决的问题是在后处理中进行抛光,然而抛光增加了成本,抛光过程难以控制抛光的厚度,使产品的尺寸出现不可控的精确度问题。产品出现的表面粗糙问题在部分医用植入领域被认为可以接受。在冯等人[24]的研究中显示,3D打印的粗糙表面的种植体,更利于组织细胞的附着。虽然在其他方面粗糙表面可能会被限制使用。在临床的实际使用中,见有报道利用3D打印成型的骨盆关节、骶骨、颅骨、足踝、关节假体、畸形矫正器和胸骨等,3D打印
均能快速成型,并植入人体需要的部位,与自然骨配合很好,均达到较理想的治疗效果[25] [26] [27] [28][29]。虽然以上3D打印产品尺寸的具体偏差并未表明,但是证据已能够表明3D打印的钛合金产品质量已能满足部分临床使用的要求。
3.2. 机械性能
用于骨骼修复的TC4钛合金人工骨,通常被运用在必须承重的骨骼部位,需要能承受一定的载荷,所以要求TC4钛合金人工骨必须具有足够的机械性能。已有的研究[30]发现,3D打印的TC4钛合金件的机械性能并非都是一致的,不一样的工艺参数,会使产品的机械性能产生差异,良好的机械性能取决于合适的工艺参数[31]。张等人[32]研究3D打印的TC4钛合金口腔修复产品的机械性能,结果发现3D打印完成的试件,未经过任何处理,它们的维氏硬度值在372.93~428.46 HV 的范围,高于传统制造方式生产的TC4钛合金的维氏硬度值[33]。抗拉强度、屈服强度和延伸率分别为1821.7 ± 146.2 MPa、1355.9 ± 109.7 MPa和31.3 ± 1.8%,机械性能保持着良好的状态,能满足相关的国家标准[34]。3D打印金属材料的过程不同于传统的制造方法,它常使原材料经历着加热–融化–冷却的过程,并不断在金属分层重复这一过程,熔融后的金属粉末,由于冷却速率快速,会导致力学性能和几何尺寸缺陷[35]。对于竣工后的产品进行热处理,被认为是提高3D打印后的TC4钛合金力学性能和几何质量的有效方法[36]。吴等人[37]对3D打印后进行热处理的TC4钛合金件进行拉伸强度测试,结果显示它们的抗拉强度、屈服强度、延伸率等机械性能均优于传统制造方式的同类产品(表1),它们的耐磨损性能甚至高于天然牙齿的牙釉质(表2),对其进行拉伸断裂的断口进行扫描电镜(SEM)表征发现,它们断裂形式属于韧性断裂(图1),证明其塑性良好。其他的报道中[38],研究人员称利用SLM 技术制备的接骨板经过简单的热处理后其硬度高于钛合金铸件,极限拉伸强度、屈服强度和伸长率均满足常规钛合金的力学要求。在朱、张等人[39] [40] [41] [42]的研究中,发现3D打印制造的TC4钛合金产品,经过一系列的后处理,在密度、强度、塑性、冲击韧性和疲劳强度等指标均可以与传统方法制造的钛合金件媲美甚至更优。另一项研究中[43],利用3D打印制备孔径约为400 μm 的TC4钛合金支架,其极限抗压强度和剪切强度均较致密结构的TC4钛合金材料有所下降,但接近人骨的力学性能,满足人骨植入物的力学性能要求。在临床使用的案例中[44],有多例患者使用了3D打印TC4钛合金重建脊柱,治疗因疾病造成的骨缺损,治疗效果很好,在随访期间植入物并未发生断裂等机械失效。
由此可见3D打印TC4钛合金产品可以满足人工骨材料的要求。


3.3. 生物相容性
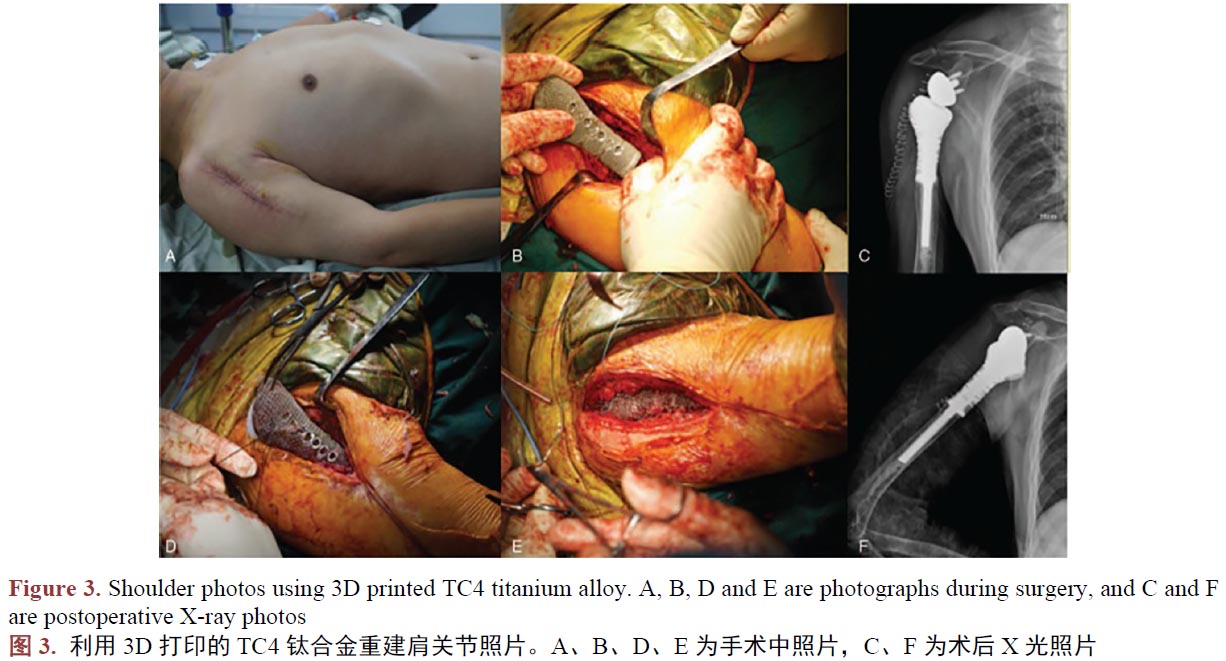
医用钛合金作为人体组织的替代物植入人体,与人体组织形成结合,须在人体内不产生排异反应,所以新型工艺制备的钛合金生物相容是评价其能否替代传统工艺的另一个重要的指标。在植入动物体进行3D打印TC4钛合金件的生物相容性评估时,学者们尝试过将3D打印制备的蜂窝状多孔TC4钛合金支架、TC4牙种植体、骨干,植入兔、犬等动物体,结果都指明了其在动物体中的骨结合很稳固,并未出现植入物周围组织粘连、充血、水肿、坏死等令人担忧的现象[45]-[50]。作为进一步验证,临床使用的案例研究中,学者们记录和研究了临床一些真实病人使用3D打印技术制备的TC4钛合金产品,植入手臂(图2) [51]、肩关节(图3) [52]、颈椎骨[53]、胫骨[54] [55]、下颌骨等[56]部位,在研究期间发现3D打印技术制备TC4钛合金人工骨具有较强的组织结合能力,且软组织能牢固的附着于材料表面,其中所有患者没有出现因假体的植入造成感染和排异反应。所以我们认为3D打印制备的钛合金人工骨具有良好的生物相容性。

3.4. 生物安全性
3D打印制备作为新型工艺,制备的人工骨材料,是否会对细胞具有毒性,或者是否会增加植入物感染等问题,也已被学者们进行验证。已有报道称在景、王、李等人[57] [58] [59] [60]的研究中,3D打印制备的TC4钛合金对体外成骨细胞的体外增殖和分化没有不良影响,没有细胞毒性。王、肖等学者[61] [62] [63]研究得出3D打印制备的钛合金种植体,对动物体不具有亚慢性全身毒性,对动物组织细胞无毒副作用,在动物体内不会发生明显的材料磨损脱落。在临床上,学者们发现3D打印制备的TC4钛合金种植体生物安全性能良好,在多例病例中,病人下颌骨(图4,A 为术前照片,B、C 为术中照片,D 为术后照片) [64] [65]、胸骨[66]、颅骨[67]、股骨[68]、脊椎[69]等重要部位植入3D打印的钛合金产品,重建缺损部位,结果,大部分病人术后伤口愈合良好,研究的病例中仅有小部分病人发现植入物周围感染,感染病人比例在正常范围内,并未发现病例因为植入材料本身引起的感染。这些证据表明3D打印的钛合金件生物安全性是可靠的。

3.5. 耐腐蚀性能
钛及其合金因其良好的耐腐蚀性能而闻名。然而钛的耐腐蚀,并非该金属具有高度不活泼的性质,实际上,钛是一种较活泼的金属元素,使钛合金耐腐蚀的是它表面的二氧化钛钝化膜。氧化的二氧化钛覆盖于钛合金表面形成致密的薄膜,使钛合金钝化从而阻止金属进一步腐蚀,达到抗腐蚀的功能[70] [71][72]。耐腐蚀性能的保持对种植体的机械性能和生物相容性的影响会种植体的整个使用寿命,过快的腐蚀会导致植入物过早的失效。作为一种先进的智能制造技术,3D打印的TC4钛合金的耐腐蚀性能是否与传统工艺制备的TC4钛合金件一样,是否能满足临床对此类金属材料的腐蚀行为的要求一样至关重要。
由于制造工艺的不同,马等学者[73]发现,3D打印制备的TC4钛合金件的耐腐蚀性能明显差于锻造等传统工艺制备的同种钛合金。造成腐蚀性差的原因可能是,由于3D打印的钛合金产品表面较粗糙导致,经过进一步的表面处理可以提高耐腐蚀性,解决这一问题,在J Fojt、白等学者[74] [75]的研究中已证实了这一观点。然而对于人工骨材料,粗糙的表面可能更适用,抛光处理后耐腐蚀性能增强,带来的是生物活性变差。由此可见,3D打印的TC4钛合金如果不经过后续的表面修改处理,其耐腐蚀性能会明显变差,但是可能带来的是更好的生物活性,两者应该权衡取舍。上述的临床案例并未发现产品在寿命内由于腐蚀严重导致的失效。由此可见3D打印的TC4钛合金的耐腐蚀性并非难以接受,或者可以选择表面修饰进一步补偿耐腐蚀性能的不足。
4、3D打印钛合金的表面改性
与传统的加工工艺类似,3D打印技术只是改变了材料的加工的方式,并没有从根本上改变材料的性质。
所以 3D打印钛合金产品中,钛合金材料本身缺点依然存在.仍需要进行进一步的表面修饰。借鉴对常规加工的钛合金表面改性的策略,可以选择对3D打印钛合金进行机械改性、化学改性和复合材料[76] [77] [78]。
对用植入钛合金,常用的机械改性的方法如表面喷砂、激光雕刻纹理等。喷砂和激光雕刻的目的是在钛合金件表面制造凹凸地形。已有的研究显示[79],凹凸地形的钛合金表面具有一定的生物活性,能带来更好的骨结合,并且不会对材料的力学性能和生物安全性带来很大的影响,属于较经济实用的表面改性方法。
常用的化学改性的方法有酸蚀、碱蚀、碱热处理、表面氧化等,这样的方式也是为了在TC4钛合金表面发生化学反应,生成生物活性更好、耐腐蚀性能更强的物质[80]。酸蚀、碱蚀能进一步制造不规则的分层微、纳米的多孔结构,并且在改性钛表面生成生物活性更强耐腐蚀性能更好的TiO2,达到增强其表面的生物活性的同时提高材料的耐腐蚀性能[81] [82]。酸蚀和碱蚀的方法常常在喷砂后进行,这样做的目的既能清理钛合金表面残留的砂粒,又能将喷砂造成的粗糙表面进一步活化。复合材料的方法是在钛合金件表面复合一
层具有特殊功能的材料,能达到改善钛合金的耐腐蚀性、耐磨性、生物活性、抗菌性能等(图5,A 和D、B 和E、C 和F 分别对应的是改性前的钛合金、利用水热法在钛合金表面制备Ca、P、O 涂层的改性钛合金、利用微弧氧化在钛合金表面制备Ca、P、O 涂层的改性钛合金。G 为骨向种植体内生长的定量分析,H为骨与种植体接触的定量分析。更多的骨向内生长和更多的骨与种植体接触面积,证明对应材料的生物活性更好。) [83] [84] [85]。复合材料常以涂层的方式涂覆于钛合金基体表面,它常常使改性钛合金兼具钛合金本身优异的性能和表面复合的材料的性能。常被用于复合在钛合金基体表面,用于提高改性钛的生物活性的材料有磷酸钙、聚多巴胺等生物活性更好的材料。磷酸钙优秀的骨诱导性能已得到广泛的认可。在已有的研究中[86] [87] [88] [89],通过在钛合金表面复合磷酸钙、聚多巴胺等生物活性更好的材料,确实在一定程度上改善了改性钛合金的生物活性。为更大限度的赋予涂层神奇的功能,可以在涂层中掺入一些金属元素,使涂层具有抗菌、更强的生物活性的功效。其中,银、锶、锌常被作为涂层的掺杂成分。TC4钛合金种植体常由于不具备抗细菌感染的能力,这种功能的缺失会容易在进行种植手术时发生细菌感染,造成植入手术的失败,于是具有抗菌性能的复合涂层展现出了巨大的潜力。银是一种天然的抗菌元素,有报道称[90] [91] [92],在他们的研究中,在TC4钛合金表面复合掺杂银和锶的羟基磷灰石涂层,使改性TC4钛合金具有优异的抗菌性能,同时拥有良好的生物活性。众多的表面改性的效果表明,3D打印的TC4钛合金人工骨,通过表面改性的方法,克服产品的缺点,具有巨大的前途。

5、总结和展望
3D打印技术因特有的优势,在非批量生产方面较传统的制造工艺成本低,且能针对个性化进行精准加工,符合医疗学植入物的迫切需求。作为新型的加工工艺,3D打印的产品还不能完全被人们认知和接受。上述大量的学者研究足以证明,3D打印的TC4钛合金在产品质量、机械性能、生物相容性、生物安全性和耐腐蚀性等方面的性能已能满足部分使用要求。产品在一些临床植入病人的案例中也显示出了可喜的疗效。说明3D打印TC4钛合金人工骨完全可行。至今,3D打印的TC4钛合金产品还存在一些尚未克服的问题,如产品精度仍然很有限、产品表面不光洁等。如果能完全解决上述的技术问题,3D打印将颠覆以往常规的加工方法,并刷新对TC4钛合金人工骨的认识。所以今后3D打印研究的重点可以放在提高加工精度和表面光洁度上。随着3D打印技术和表面改性技术的进步,优化性能之后的TC4钛合金人工骨将重新被人们考虑。3D打印全面取代传统的制造工艺,进行TC4钛合金人工骨的制备,并非危言耸听!
利益冲突声明
作者声明本文无利益冲突。
基金项目
本文由成都市医学科研课题(2021043),四川省教育厅高等教育人才培养质量和教学改革项目(JG2021-1102),教育部产学合作协同育人项目(202101011010),成都大学CC 国家众创空间2021 年度创新创业教育专项课题(ccyg202101008), 四川省大学生创新创业训练计划项目(S202111079028 ,S202111079043X,S202111079095,S202111079124X,S202111079041),成都大学大学生创新创业训练计划项目(CDUCX2022604,CDUCX2022600)资助。
参考文献
[1] 陈文杰. 3D打印工艺参数管理系统关键技术研究[D]: [硕士学位论文]. 徐州: 中国矿业大学, 2019.
[2] Browne, M.P., Redondo, E. and Pumera, M. (2020) 3D Printing for Electrochemical Energy Applications. Chemical Reviews, 120, 2783-2810. https://doi.org/10.1021/acs.chemrev.9b00783
[3] Jamróz, W., Szafraniec, J., Kurek, M., et al. (2018) 3D Printing in Pharmaceutical and Medical Applications—RecentAchievements and Challenges. Pharmaceutical Research, 35, 1-22. https://doi.org/10.1021/acs.chemrev.9b00783
[4] Durfee, W.K. and Iaizzo, P.A. (2019) Medical Applications of 3D Printing. In: Iaizzo, P.A., Ed., Engineering in Medicine:Advances and Challenges, Academic Press, Cambridge, 527-543.
https://doi.org/10.1016/B978-0-12-813068-1.00021-X
[5] 施建平. 面向骨植入体3D打印的多孔结构构建研究[D]: [博士学位论文]. 南京: 东南大学, 2018.
[6] 胡婧, 陶梅平, 唐金颖. 3D打印TC4钛合金的成形工艺与热处理行为研究[J]. 热加工工艺, 2017, 46(16):220-224.
[7] 李豪杰. 3D打印与传统加工TC4钛合金组织与力学性能对比研究[D]: [硕士学位论文]. 北京: 北方工业大学,2019.
[8] 吴栋. 关于TC4 基表面ZnO/HA 复合涂层的制备与性能研究[D]: [硕士学位论文]. 兰州: 兰州理工大学, 2020.
[9] Ganesh, N. and Rambabu, S. (2021) Finite Element Analysis of Porous Ti-6Al-4V Alloy Structures for BiomedicalApplications. Journal of Physics: Conference Series, 2070, Article ID: 012224.
https://doi.org/10.1088/1742-6596/2070/1/012224
[10] Shen, X. and Shukla, P. (2020) A Review of Titanium Based Orthopaedic Implants (Part-I): Physical Characteristics,Problems and the Need for Surface Modification. International Journal of Peening Science and Technology, 1, 301-332.
[11] Zheng, J., Chen, L., Chen, D., et al. (2019) Effects of Pore Size and Porosity of Surface-Modified Porous TitaniumImplants on Bone Tissue Ingrowth. Transactions of Nonferrous Metals Society of China, 29, 2534-2545.
https://doi.org/10.1016/S1003-6326(19)65161-7
[12] Kapat, K., Maity, P.P., Rameshbabu, A.P., et al. (2018) Simultaneous Hydrothermal Bioactivation with Nano-TopographicModulation of Porous Titanium Alloys towards Enhanced Osteogenic and Antimicrobial Responses. Journal of MaterialsChemistry B, 6, 2877-2893.
https://doi.org/10.1039/C8TB00382C
[13] McGilvray, K.C., Easley, J., Seim, H.B., et al. (2018) Bony Ingrowth Potential of 3D-Printed Porous Titanium Alloy:A Direct Comparison of Interbody Cage Materials in an in Vivo Ovine Lumbar Fusion Model. The Spine Journal, 18,1250-1260.
https://doi.org/10.1016/j.spinee.2018.02.018
[14] Xia, Y., Feng, C., Xiong, Y., et al. (2019) Mechanical Properties of Porous Titanium Alloy Scaffold Fabricated UsingAdditive Manufacturing Technology. International Journal of Applied Electromagnetics and Mechanics, 59, 1087-1095.
https://doi.org/10.3233/JAE-171197
[15] 赵立明. 3D打印钛合金骨小梁骨干假体在山羊体内骨长入的实验研究[D]: [硕士学位论文]. 天津: 天津医科大学, 2017.
[16] 张兰, 王翔, 刘军, 等. 3D打印钛合金骨小梁多孔结构的拉伸性能[J]. 中国组织工程研究, 2020, 24(22):3498-3503.
[17] Hedia, H.S., Aldousari, S.M., Timraz, H.A., et al. (2019) Stress Shielding Reduction via Graded Porosity of a Femoral Stem Implant. Materials Testing, 61, 695-704. https://doi.org/10.3139/120.111374
[18] Al-Tamimi, A.A. (2021) 3D Topology Optimization and Mesh Dependency for Redesigning Locking Compression Plates Aiming to Reduce Stress Shielding. International Journal of Bioprinting, 7, 339-348.
https://doi.org/10.18063/ijb.v7i3.339
[19] 李崇崇, 付步芳, 杜晓丹, 等. 3D打印个体化骨盆假体多孔结构物理性能检测方法研究[J]. 生物医学工程与临床, 2020, 24(2): 126-130.
[20] Zheng, Y., Han, Q., Wang, J., et al. (2020) Promotion of Osseointegration between Implant and Bone Interface by Titanium Alloy Porous Scaffolds Prepared by 3d Printing. ACS Biomaterials Science & Engineering, 6, 5181-5190.
https://doi.org/10.1021/acsbiomaterials.0c00662
[21] 孙星. 3D打印可再生多孔骨骼支架及性能研究[D]: [硕士学位论文]. 济南: 山东建筑大学, 2020.[22] Wallace, N., Schaffer, N.E., Aleem, I.S., et al. (2020) 3D-Printed Patient-Specific Spine Implants: A Systematic Review.Clinical Spine Surgery, 33, 400-407.
https://doi.org/10.1097/BSD.0000000000001026
[23] 彭文明, 刘云峰, 包霆威, 等. 3D打印多孔钛合金骨植入体设计制造研究[C]//中华口腔医学会. 第十六次全国口腔医学数字化学术会议暨中华口腔医学会第四届口腔医学计算机专业委员会第二次全体委员会议论文汇编.2018: 19-20.
[24] 冯辰栋, 夏宇, 李祥, 等. 3D打印多孔钛支架微观孔隙结构和力学性能[J]. 医用生物力学, 2017, 32(3): 256-260.
[25] Zhao, X., Xiao, J., Sun, Y., et al. (2018) Novel 3D Printed Modular Hemipelvic Prosthesis for Successful HemipelvicArthroplasty: A Case Study. Journal of Bionic Engineering, 15, 1067-1074.
https://doi.org/10.1007/s42235-018-0094-9
[26] Wei, R., Guo, W., Ji, T., et al. (2017) One-Step Reconstruction with a 3D-Printed, Custom-Made Prosthesis after Total En Bloc Sacrectomy: A Technical Note. European Spine Journal, 26, 1902-1909.
https://doi.org/10.1007/s00586-016-4871-z
[27] Ameen, W., Al-Ahmari, A., Mohammed, M.K., et al. (2018) Design, Finite Element Analysis (FEA), and Fabrication
of Custom Titanium Alloy Cranial Implant Using Electron Beam Melting Additive Manufacturing. Advances in Production
Engineering & Management, 13, 267-278. https://doi.org/10.14743/apem2018.3.289
[28] Dekker, T.J., Steele, J.R., Federer, A.E., et al. (2018) Use of Patient-Specific 3D-Printed Titanium Implants for Complex
Foot and Ankle Limb Salvage, Deformity Correction, and Arthrodesis Procedures. Foot & Ankle International,
39, 916-921. https://doi.org/10.1177/1071100718770133
[29] Wu, Y., Chen, N., Xu, Z., et al. (2018) Application of 3D Printing Technology to Thoracic Wall Tumor Resection and
Thoracic Wall Reconstruction. Journal of Thoracic Disease, 10, 6880-6890. https://doi.org/10.21037/jtd.2018.11.109
[30] Yi, T., Zhou, C., Ma, L., et al. (2020) Direct 3-D Printing of Ti-6Al-4V/HA Composite Porous Scaffolds for Customized
Mechanical Properties and Biological Functions. Journal of Tissue Engineering and Regenerative Medicine, 14,
486-496. https://doi.org/10.1002/term.3013
[31] Kushwaha, A., Kumar, S.A. and Velu, R. (2021) Selective Laser Melting of Titanium Alloys: Effect of Processing Parameters
on Microstructure and Mechanical Properties. International Journal of Mechatronics and Manufacturing Systems,
14, 128-142. https://doi.org/10.1504/IJMMS.2021.119156
[32] 张玮航, 张虎, 李英姿, 等. 3D打印激光快速成型牙种植体的制备及其机械性能分析[J]. 吉林大学学报(医学版),
2017, 43(1): 52-56+216.
[33] Jia, L.M., Liu, R.L., Liang, Z.M., et al. (2016) Research of Structure and Hardness of TC4 Alloy for Centrifugal Cast
ings. Advanced Material Engineering: Proceedings of the 2015 International Conference on Advanced Material Engineering,
Guangzhou, 15-17 May 2015, 301-307. https://doi.org/10.1142/9789814696029_0036
[34] 杨群, 陈长胜, 马忠贤, 王剑. GB/T 13810-2017《外科植入物用钛及钛合金加工材》标准解析[J]. 中国医疗器械
信息, 2019, 25(1): 14-15+53.
[35] 马涛. 激光选区熔化成形Ti-6Al-4V 疲劳性能研究[D]: [硕士学位论文]. 南京: 南京理工大学, 2019.
[36] Fousova, M. and Vojtech, D. (2018) Thermal Treatment of 3D-Printed Titanium Alloy. Manufacturing Technology,
18, 227-232. https://doi.org/10.21062/ujep/82.2018/a/1213-2489/MT/18/2/227
[37] 吴文孟, 张倩, 宁宝麟, 等. 3D打印Ti-6Al-4V 合金机械性能研究[J]. 全科口腔医学电子杂志, 2016, 3(10): 93-95.
[38] Wang, D., Wang, Y., Wu, S., et al. (2017) Customized a Ti6Al4V Bone Plate for Complex Pelvic Fracture by Selective
Laser Melting. Materials, 10, 35-48. https://doi.org/10.3390/ma10010035
[39] 朱加雷, 王凯, 马桂殿, 等. TC4钛合金激光选区熔化成形性能研究[J]. 应用激光, 2017, 37(6): 793-800.
[40] Skvortsova, S.V., German, M.A. and Spektor, V.S. (2019) Structure and Properties of Alloy Ti-6Al-4V Samples Fabricated
by 3D Printing. Russian Metallurgy (Metally), 2019, 863-872. https://doi.org/10.1134/S0036029519090106
[41] Smith, K.E., Dupont, K.M., Safranski, D.L., et al. (2016) Use of 3D Printed Bone Plate in Novel Technique to Surgically
Correct Hallux Valgus Deformities. Techniques in Orthopaedics (Rockville, Md.), 31, 181-189.
https://doi.org/10.1097/BTO.0000000000000189
[42] Zhang, C., Zhang, L., Liu, L., et al. (2020) Mechanical Behavior of a Titanium Alloy Scaffold Mimicking Trabecular
Structure. Journal of Orthopaedic Surgery and Research, 15, 1-11. https://doi.org/10.1186/s13018-018-1031-7
[43] 刘畅, 王辰宇, 刘贺, 等. 3D打印Ti6Al4V 钛合金支架的力学性能及生物相容性[J]. 中国有色金属学报, 2018,
28(4): 758-765.
[44] Girolami, M., Boriani, S., Bandiera, S., et al. (2018) Biomimetic 3D-Printed Custom-Made Prosthesis for Anterior
Column Reconstruction in the Thoracolumbar Spine: A Tailored Option Following En Bloc Resection for Spinal Tumors.
European Spine Journal, 27, 3073-3083. https://doi.org/10.1007/s00586-018-5708-8
[45] 芮敏, 郑欣, 张云庆, 等. 3D打印多孔钛合金支架修复兔桡骨骨缺损[J]. 中国组织工程研究, 2019, 23(18):
2789-2793.
[46] Tu, C.C., Tsai, P.I., Chen, S.Y., et al. (2020) 3D Laser-Printed Porous Ti6Al4V Dental Implants for Compromised
Bone Support. Journal of the Formosan Medical Association, 119, 420-429. https://doi.org/10.1016/j.jfma.2019.07.023
[47] 王蕊, 李美华, 周万琳. 3D打印钛合金种植体的制备及其骨结合性能[J]. 吉林大学学报(医学版), 2021, 47(1):
82-88.
[48] 周万琳. 选择性激光烧结3D打印钛合金种植体的制备及其体内研究[D]: [硕士学位论文]. 长春: 吉林大学,
2019.
[49] 张剑锋. 3D打印组配式节段型人工假体重建骨干缺损的实验研究[D]: [博士学位论文]. 天津: 天津医科大学,
2019.
[50] 向健, 杨立峰, 田胜慧, 等. 新型3D打印骨修复体的骨组织相容性研究[J]. 中国医学工程, 2018, 26(10): 26-29.
[51] Park, J.W., Song, C.A., Kang, H.G., et al. (2020) Integration of a Three-Dimensional-Printed Titanium Implant in
Human Tissues: Case Study. Applied Sciences, 10, 553-561. https://doi.org/10.3390/app10020553
[52] Zou, Y., Yang, Y., Han, Q., et al. (2018) Novel Exploration of Customized 3D Printed Shoulder Prosthesis in Revision
of Total Shoulder Arthroplasty: A Case Report. Medicine, 97, e13282-e13288.
https://doi.org/10.1097/MD.0000000000013282
[53] Wei, F., Li, Z., Liu, Z., et al. (2020) Upper Cervical Spine Reconstruction Using Customized 3D-Printed Vertebral
Body in 9 Patients with Primary Tumors Involving C2. Annals of Translational Medicine, 8, 332-340.
https://doi.org/10.21037/atm.2020.03.32
[54] Guder, W.K., Hardes, J., Nottrott, M., et al. (2021) Highly Cancellous Titanium Alloy (TiAl6V4) Surfaces on
Three-Dimensionally Printed, Custom-Made Intercalary Tibia Prostheses: Promising Short- to Intermediate-Term Results.
Journal of Personalized Medicine, 11, 351-360. https://doi.org/10.3390/jpm11050351
[55] Zhang, Y., Zhang, L., Sun, R., et al. (2018) A new 3D Printed Titanium Metal Trabecular Bone Reconstruction System
for Early Osteonecrosis of the Femoral Head. Medicine, 97, e11088-e11096.
https://doi.org/10.1097/MD.0000000000011088
[56] Park, J.H., Odkhuu, M., Cho, S., et al. (2020) 3D-Printed Titanium Implant with Pre-Mounted Dental Implants for
Mandible Reconstruction: A Case Report. Maxillofacial Plastic and Reconstructive Surgery, 42, 1-4.
[57] 景丽, 史文, 曹雨, 等. 3D打印钛合金多孔材料对体外成骨细胞系MC3T3-E1 的生物安全性[J]. 基础医学与临
床, 2020, 40(10): 1374-1380.
[58] 王骅, 王鹞, 张彪. 3D打印钛合金牙种植体的细胞毒性的研究[J]. 中国口腔种植学杂志, 2019, 24(1): 10-13.
[59] 李改明, 刘思雨, 战德松, 等. 3D打印医用钛合金的抗菌性能和体外生物相容性[J]. 材料研究学报, 2019, 33(2):
117-123.
[60] 李军, 魏建华, 张玉梅, 等. 新型医用钛合金生物相容性评价[J]. 实用口腔医学杂志, 2010, 26(5): 636-640.
[61] 王涵, 赵丹妹, 许建霞, 等. 3D打印骨科钛合金的亚慢性全身毒性研究[J]. 组织工程与重建外科杂志, 2020,
16(1): 6-10.
[62] Chioibasu, D., Achim, A., Popescu, C., et al. (2019) Prototype Orthopedic Bone Plates 3D Printed by Laser Melting
Deposition. Materials, 12, 906-925. https://doi.org/10.3390/ma12060906
[63] 肖维维. 3D打印钛合金下颌骨接骨板的有效性和安全性的初步研究[D]: [硕士学位论文]. 西安: 中国人民解放
军空军军医大学口腔医学院, 2018.
[64] Mangano, C., Bianchi, A., Mangano, F.G., et al. (2020) Custom-Made 3D Printed Subperiosteal Titanium Implants for
the Prosthetic Restoration of the Atrophic Posterior Mandible of Elderly Patients: A Case Series. 3D Printing in Medicine,
6, 1-14. https://doi.org/10.1186/s41205-019-0055-x
[65] Popovski, V., Benedetti, A., Panchevski, G., et al. (2020) Emergency State of Mandible Fracture Management in
COVID-19 Pandemic Area: A Case Report. Journal of Morphological Sciences, 3, 107-113.
[66] Goldsmith, I., Evans, P.L., Goodrum, H., et al. (2020) Chest Wall Reconstruction with an Anatomically Designed 3-D
Printed Titanium Ribs and Hemi-Sternum Implant. 3D Printing in Medicine, 6, 26.
https://doi.org/10.1186/s41205-020-00079-0
[67] Park, E.K., Lim, J.Y., Yun, I.S., et al. (2016) Cranioplasty Enhanced by Three-Dimensional Printing: Custom-Made
Three-Dimensional-Printed Titanium Implants for Skull Defects. Journal of Craniofacial Surgery, 27, 943-949.
https://doi.org/10.1097/SCS.0000000000002656
[68] Zhang, Y., Zhang, L.L., Xiang, H., et al. (2017) The Effectiveness of 3D Printed Titanium Alloy Trabecular Reconstruction
rod for the Treatment of Early Osteonecrosis of Femoral Head. Tianjin Medical Journal, 45, 1222-1227.
[69] Zhou, H., Liu, S., Li, Z., et al. (2022) 3D-Printed Vertebral Body for Anterior Spinal Reconstruction in Patients with
Thoracolumbar Spinal Tumors. Journal of Neurosurgery: Spine, 1, 1-9. https://doi.org/10.3171/2022.1.SPINE21900
[70] Geetha, M., Singh, A.K., Asokamani, R., et al. (2009) Ti Based Biomaterials, the Ultimate Choice for Orthopaedic Implants—
A Review. Progress in Materials Science, 54, 397-425. https://doi.org/10.1016/j.pmatsci.2008.06.004
[71] Bocchetta, P., Chen, L.Y., Tardelli, J.D.C., et al. (2021) Passive Layers and Corrosion Resistance of Biomedical
Ti-6Al-4V and β-Ti Alloys. Coatings, 11, 487-518. https://doi.org/10.3390/coatings11050487
[72] Saini, M., Singh, Y., Arora, P., et al. (2015) Implant Biomaterials: A Comprehensive Review. World Journal of Clinical
Cases: WJCC, 3, 52-57. https://doi.org/10.12998/wjcc.v3.i1.52
[73] Mah, D., Pelletier, M.H., Lovric, V., et al. (2019) Corrosion of 3D-Printed Orthopaedic Implant Materials. Annals of
Biomedical Engineering, 47, 162-173. https://doi.org/10.1007/s10439-018-02111-1
[74] Fojt, J., Hybášek, V., Kačenka, Z., et al. (2020) Influence of Surface Finishing on Corrosion Behaviour of 3D Printed
TiAlV Alloy. Metals, 10, 1547-1557. https://doi.org/10.3390/met10111547
[75] Bai, C., Li, P., Gang, T., et al. (2021) Influence of Processing Technology on Electrochemical Corrosion Behavior of
Ti-6Al-4V Alloys. Corrosion, 77, 402-412. https://doi.org/10.5006/3490
[76] Liang, C.Y., Jiang, X.J., Ji, R.L., et al. (2021) Preparation and Surface Modification of 3D Printed Ti-6Al-4V Porous
Implant. Rare Metals, 40, 1164-1172. https://doi.org/10.1007/s12598-020-01413-5
[77] Xu, J., Zhang, J., Shi, Y., et al. (2022) Surface Modification of Biomedical Ti and Ti Alloys: A Review on Current
Advances. Materials, 15, 1749-1777. https://doi.org/10.3390/ma15051749
[78] Wang, Q., Zhou, P., Liu, S., et al. (2020) Multi-Scale Surface Treatments of Titanium Implants for Rapid Osseointegration:
A Review. Nanomaterials, 10, 1244-1270. https://doi.org/10.3390/nano10061244
[79] Demirci, S., Dikici, T. and Güllüoğlu, A.N. (2022) Micro/Nanoscale Surface Modification of Ti6Al4V Alloy for Implant
Applications. Journal of Materials Engineering and Performance, 31, 1503-1511.
https://doi.org/10.1007/s11665-021-06232-y
[80] Cheung, K.H., Pabbruwe, M.B., Chen, W.F., et al. (2021) Thermodynamic and Microstructural Analyses of Photocatalytic
TiO2 from the Anodization of Biomedical-Grade Ti6Al4V in Phosphoric Acid or Sulfuric Acid. Ceramics International,
47, 1609-1624. https://doi.org/10.1016/j.ceramint.2020.08.277
[81] Cervino, G., Fiorillo, L., Iannello, G., et al. (2019) Sandblasted and Acid Etched Titanium Dental Implant Surfaces
https://doi.org/10.3390/ma12111763
[82] Luo, Y., Jiang, Y., Zhu, J., et al. (2020) Surface Treatment Functionalization of Sodium Hydroxide onto 3D Printed
Porous Ti6Al4V for Improved Biological Activities and Osteogenic Potencies. Journal of Materials Research and
Technology, 9, 13661-13670. https://doi.org/10.1016/j.jmrt.2020.09.076
[83] Afrouzian, A., Avila, J.D. and Bandyopadhyay, A. (2021) Biotribocorrosion of 3D-Printed Silica-Coated Ti6Al4V for
Load-Bearing Implants. Journal of Materials Research, 36, 3974-3984. https://doi.org/10.1557/s43578-021-00277-4
[84] Huang, L., Cai, B., Huang, Y., et al. (2021) Comparative Study on 3D Printed Ti6Al4V Scaffolds with Surface Modifications
Using Hydrothermal Treatment and Microarc Oxidation to Enhance Osteogenic Activity. ACS Omega, 6,
1465-1476. https://doi.org/10.1021/acsomega.0c05191
[85] Shanmugapriya, P., Srinivasan, V., Karthikeyan, B., et al. (2020) Wear Study on Sol-Gel-Coated Ti-6Al-4V Alloy.
Journal of Bio- and Tribo-Corrosion, 6, 1-12. https://doi.org/10.1007/s40735-020-00423-1
[86] Qin, J., Yang, D., Maher, S., et al. (2018) Micro- and Nano-Structured 3D Printed Titanium Implants with a Hydroxyapatite
Coating for Improved Osseointegration. Journal of Materials Chemistry B, 6, 3136-3144.
https://doi.org/10.1039/C7TB03251J
[87] Wang, C., Hu, H., Li, Z., et al. (2019) Enhanced Osseointegration of Titanium Alloy Implants with Laser Microgrooved
Surfaces and Graphene Oxide Coating. ACS applied materials & interfaces, 11, 39470-39483.
https://doi.org/10.1021/acsami.9b12733
[88] Li, L., Li, Y., Yang, L., et al. (2019) Polydopamine Coating Promotes Early Osteogenesis in 3D Printing Porous Ti6Al4V
Scaffolds. Annals of Translational Medicine, 7, 240-253. https://doi.org/10.21037/atm.2019.04.79
[89] Wang, S., Li, R., Li, D., et al. (2018) Fabrication of Bioactive 3D Printed Porous Titanium Implants with Sr
ion-Incorporated Zeolite Coatings for Bone Ingrowth. Journal of Materials Chemistry B, 6, 3254-3261.
https://doi.org/10.1039/C8TB00328A
[90] Fielding, G.A., Roy, M., Bandyopadhyay, A., et al. (2012) Antibacterial and Biological Characteristics of Silver Containing
and Strontium Doped Plasma Sprayed Hydroxyapatite Coatings. Acta Biomaterialia, 8, 3144-3152.
https://doi.org/10.1016/j.actbio.2012.04.004
[91] Wang, B., Ma, L., Xie, L., et al. (2020) Chemical Stability, Antibacterial and Osteogenic Activities Study of Strontium-
Silver Co-Substituted Fluorohydroxyapatite Nanopillars: A Potential Multifunctional Biological Coating. Ceramics
International, 46, 27758-27773. https://doi.org/10.1016/j.ceramint.2020.07.275
[92] O’Sullivan, C., O’Neill, L., O’Leary, N.D., et al. (2021) Osteointegration, Antimicrobial and Antibiofilm Activity of
Orthopaedic Titanium Surfaces Coated with Silver and Strontium-Doped Hydroxyapatite Using a Novel Blasting
Process. Drug Delivery and Translational Research, 11, 702-716. https://doi.org/10.1007/s13346-021-00946-1
相关链接













